Объект и программа исследований
Кратко состав атома записывается:
32S 16р, 16n, 11e.
Электронная схема атома натрия:
16 S 2е, 8е, 6е.
Электронная формула:
16S 1s22s22p63s23p4
Электронно-графическая схема:
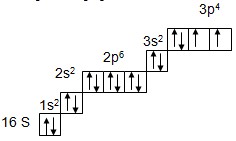
Электронная конфигурация внешнего энергетического уровня 2s23p4, р-элемент.
Сера-неметалл.
Степень окисления:
а) в высших оксидах - +6
б) в летучих водородных соединениях - -2.
Электроотрицательность:(S)=2,60.
Формула высшего оксида – SO3; кислотный.
Формула гидроксида: H2SO4 – серная кислота.
Летучее водородное соединение – H2S.
Закрепление нового материала.
Самостоятельная работа учащихся по новой теме:
Опишите согласно приведенному алгоритму следующие химические элементы: а) Ве; б) F; в) Al; г) Cl; д) К (количество химических элементов по количеству учеников в классе).
Итоги урока.
Для анализа самостоятельной деятельности учащихся была проведена контрольная работа по теме: «Важнейшие химические понятия и законы». Контролировались в этой контрольной работе следующие элементы знаний и умений:
умение характеризовать и применять понятия «атом», «молекула», «относительная атомная масса», «относительная молекулярная масса», «молярный объем»;
умение давать характеристику вещества по качественному и количественному составу;
умение вести расчеты: массовой доли элементов в соединении, массы вещества, молярной массы, относительной плотности вещества;
умение решать расчетные задачи типа: определить химическую формулу неизвестного вещества по массовой доле элементов.
1 вариант
Укажите схему реакции, отражающую химическое явление:
![]() а) Н2О (жидк.) Н2О (газ.);
а) Н2О (жидк.) Н2О (газ.);
![]() б) С (тв.) + О2 (газ.) СО2 (газ.);
б) С (тв.) + О2 (газ.) СО2 (газ.);
![]() в) HCl (газ.) HCl (водный р-р);
в) HCl (газ.) HCl (водный р-р);
![]() г) I2 (тв.) I2 (газ.).
г) I2 (тв.) I2 (газ.).
Наибольшее число молекул при температуре 4 0С и давлении 1 атм. содержится в 10 л: а) воды; б) сероводорода; в) водорода; г) хлороводорода.
Укажите число атомов в 2 г озона: а) 0,65 . 1023; б) 0,75 . 1023; в) 0,85 . 1023; г) 0,95 . 1023.
До и после химической реакции не изменяются: а) число молекул; б) число атомов; в) количество исходных веществ; г) количество веществ продуктов.
Газ количеством 0,5 моль имеет массу 8 г. Его молярная масса равна: а) 6 г / моль; б) 16 г / моль; в) 28 г / моль; г) 32 г/моль.
Плотность паров серы по водороду при некоторых условиях равна 32. Укажите формулу серы при этих условиях: а) S8; б) S4; в) S2; г) S6.
Массовая доля хлора в его оксиде равна 59,66%. Укажите формулу оксида: а) Сl2О; б) ClО3; в) Сl2О5; г) Сl2О7.
Установите молекулярную формулу вещества, если в нем массовые доли элементов составляют С – 68,85%; Н – 4,92%; О – 26,23%: а) С6Н5ОН; б) С6Н12О6; в) С7Н6О2; г) нет правильного ответа.
Актуально о образовании:
Анализ результатов диагностики особенностей
лексической стороны речи детей контрольной группы
В экспериментальном исследовании с целью изучения особенностей лексической стороны речи у детей 5 - 6 лет мы применили диагностические методики Е.Ф. Архиповой[2] «Исследование семантической структуры слова и лексической системности»: · методика №1 «Классификация понятий», · методика № 2 «Подбор ант ...
Лингвометодические условия формирования умения дифференцировать синонимы
имен прилагательных
Речь человека является своеобразным зеркалом культуры и образованности. По речи сразу можно определить уровень мышления говорящего, а также уровень его интеллектуального развития. Развитие речи является одним из принципов построения программы по русскому языку для начальных классов. В программе зап ...
Методика формирования пространственного образа на
уроках геометрии
Одним из основных условий формирования пространственных представлений в процессе обучения геометрии является использование упражнений, ориентированных на формирование и развитие комплекса умений, составляющих содержание пространственных представлений и характеризующих их сформированность. Но не все ...

