Положение алюминия в периодической системе и строение его атома
Оксид азота(IV) имеет и характерный резкий запах, и рыжевато-бурый цвет, оттенки которого отличаются друг от друга в зависимости от концентрации. Именно за этот цвет выбросы оксидов азота в атмосферу называют «лисьими хвостами».
Реакции оксида NO2
1) С водой:
2NO2 + Н2O = НNO3 + НNO2.
2) С щелочами:
2NO2 + 2NaOH = NаNО3 + NаNО2 + Н2O.
3) Димеризация при охлаждении:
![]()
При температуре –11 °С равновесие полностью смещено вправо, а при +140 °С – целиком влево.
N+52O5 – оксид азота(V), азотный ангидрид, кислотный оксид, сильный окислитель. Оксид N2O5 легко разлагается:
2N2O5 = 4NO2 + O2.
Азотная кислота
Из гидроксидов азота мы рассмотрим наиболее многотоннажный – азотную кислоту.
Молекула азотной кислоты полярна (из-за разной электроотрицательности кислорода и водорода, потому что азот как бы скрыт внутри молекулы) и асимметрична. Все три имеющихся в ней угла между связями азота с кислородом разные. Формальная степень окисления азота высшая (+5). Но при этом только 4 связи у атома азота с другими атомами – валентность азота равна 4.
Строение молекулы легче понять, если рассмотреть процесс ее получения. Азотная кислота получается при реакции оксида азота(IV) с водой (в присутствии кислорода): две молекулы NO2 одновременно «атакуют» молекулу воды своими неспаренными электронами, в результате связь водорода с кислородом разрывается не как обычно (пара электронов у кислорода и «голый протон»), а одной молекуле NO2 достается водород со своим электроном, другой – радикал ОН (рис. 8). Образуются две кислоты: обе кислоты сильные, обе быстро отдают свой протон ближайшим молекулам воды и остаются в итоге в виде ионов NO2- и NO3-. Ион NO2- нестоек, две молекулы НNО2 разлагаются на воду, NО2 и NО. Оксид NO реагирует с кислородом, превращаясь в NО2, и так до тех пор, пока не получится одна только азотная кислота.
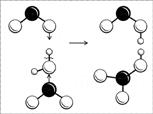
Рис. 8. Схема образования молекул азотной и азотистой кислот. (Черный шар – атом N, большие белые шары – атомы O, маленькие белые шарики – атомы H.)
Формально выходит, что с одним атомом кислорода атом азота связан двойной связью, а с другим – обычной одинарной связью (этот атом кислорода связан еще и с атомом водорода). С третьим атомом кислорода азот в HNO3 связан донорно-акцепторной связью, причем в качестве донора выступает атом азота. Гибридизация атома азота при этом должна быть sр2 из-за наличия двойной связи, что определяет структуру – плоский треугольник. Реально получается, что действительно фрагмент из атома азота и трех атомов кислорода – плоский треугольник, только в молекуле азотной кислоты этот треугольник неправильный – все три угла ОNО разные, следовательно, и разные стороны треугольника. Когда же молекула диссоциирует, треугольник становится правильным, равносторонним. Значит, и атомы кислорода в нем становятся равноценными. Одинаковыми становятся и все связи.
Физические свойства азотной кислоты
Соединение ионизированное, пусть даже и частично, сложно перевести в газ. Таким образом, температура кипения должна бы быть достаточно высокой, однако при такой небольшой молекулярной массе температура плавления высокой быть не должна. Следовательно, агрегатное состояние при 20°С жидкое. Что касается растворимости, то, как и многие другие полярные жидкости, азотная кислота легко смешивается с водой в любых соотношениях. Чистая азотная кислота бесцветна и не имеет запаха. Однако из-за разложения на кислород и оксид азота(IV), который в ней же и растворяется, можно сказать, что обычная концентрированная азотная кислота имеет желто-бурый цвет и характерный для NO2 резкий запах. Посмотрим, как влияет строение молекулы азотной кислоты на ее химические свойства.
НNО3 – cильный окислитель
При взаимодействии НNО3 с металлами (М) водород не выделяется:
М + НNО3 ® соль + вода + газ.
Смесь HNO3 (конц.) с HCl (конц.) в объемном соотношении 1:3 (1V HNO3 + 3V HCl) называют «царской водкой».
Au + HNO3 + 3HCl = AuCl3 + NO![]() + 2H2O.
+ 2H2O.
Азотная кислота не реагирует с другими кислотами по типу реакций обмена или соединения. Однако вполне способна реагировать как сильный окислитель. В смеси концентрированных азотной и соляной кислот протекают обратимые реакции, суть которых можно обобщить уравнением:
Актуально о образовании:
Понятие «творчество», виды творческих способностей
Развитие детей, это, прежде всего культура, творчество Л.С. Выготский в «Психологии искусств» поставил задачу рассмотрения психического развития творческих процессов. «Всякая функция в творческом развитии ребенка появляется на сцену дважды, в двух планах, сперва – социальном, потом – психическом». ...
Образовательная реформа Петра Великого
Благодаря Петру в России возникла система профессионального образования. В 1701 г. были созданы навигацкая, пушкарская, госпитальная, приказная и другие школы, находившиеся в ведении соответствующих государственных органов. Кроме того, к 1722 году в разных городах России были открыты 42 так называе ...
Межпредметные связи в процессе изучения химии
Отражение межпредметных связей и определение содержания в программах: а) для обычных классов без специализации – программа курса химии для 8-11 классов средней общеобразовательной школы – разработана в лаборатории химического образования Института общеобразовательной школы РАО – Москва “Просвещение ...

