Положение алюминия в периодической системе и строение его атома
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
+3Al 2e-, 8e-, 3e-
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s2-электронов и один электрон переходит 3p-орбиталь:

В результате получаются три неспаренных электрона. Ответьте на вопрос 1 .
Нахождение алюминия в природе, его получение и свойства
Алюминий — третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.
Схема 19
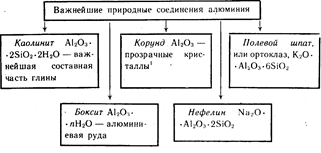
Окрашенные кристаллы Al2O3 красного цвета — рубины, синего цвета – сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl3 +3K ![]() 3KCl + Al
3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Физические свойства
Алюминий — серебристо-белый металл, легкий (r = 2,7 г/cм3), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).
Химические свойства
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl2 ® 2А1С13 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью — амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН ® 2А1(ОН)3¯ + 3Н2
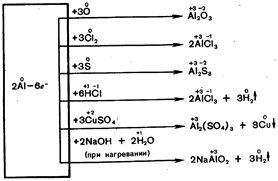
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:
Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины — сплавы алюминия с кремнием. Основные преимущества этих сплавов—легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе3O4 с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
8Al + 3Fe3O4 ® 4Al2O3 + 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2—6 (с. 138). Решите задачи 1 – 2 (с. 138). [4]
Важнейшие соединения алюминия
Оксид алюминия
Аl2О3 можно получить следующими способами:
1. Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
4Al + 3O2 ® 2А12O3
2. Путем превращения по приведенной ниже схеме:
![]()
Оксид алюминия — твердое, тугоплавкое (темп. пл. 2050 °С) вещество белого цвета.
По химическим свойствам это амфотерный оксид (I, § 37). Реагирует с кислотами, проявляет свойства основных оксидов:
А12O3 + 6НС1 ![]() 2А1С13 + 3Н2O
2А1С13 + 3Н2O
Al2O3 + 6H+ +6С1- ![]() 2Al3+ + 6С1- + 3Н2O
2Al3+ + 6С1- + 3Н2O
Актуально о образовании:
Программное обеспечение компьютерного обучения
Программное обеспечение является важным фактором, оказывающим большое влияние на качество компьютерного обучения. К настоящему времени в мире создан огромный фонд обучающих программ, часть которых используется на территории нашей страны. Этот фонд регулярно пополняется самодеятельными программами с ...
Нравственные отношения учителя и учеников в педагогической этике
В педагогической этике рассматриваются нравственные отношения учителя с учащимися. Субъектом нравственных отношений в педагогической среде является учитель. Будучи основным звеном в учебно-воспитательном процессе, он осуществляет самое широкое взаимодействие с учащимися, их родителями. Поэтому он я ...
Качества личности творческого
педагога
В широком понимании творческой индивидуальностью можно считать человека, который обладает сформировавшимся цельным ядром личности, богатым внутренним миром, обусловливающими черты характера и выражающимися в автономности, активности, своеобразии и оригинальности всех проявлений личности, в творческ ...

