Положение алюминия в периодической системе и строение его атома
Рис. 1. Молекула оксида азота(I) – N2O
|
|
|
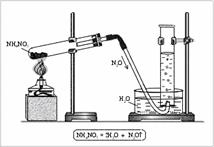
Рис. 2. Получение оксида азота(I) в лаборатории |
Оксид N2O разлагается при нагревании:
![]()
Оксид N2O реагирует с водородом:
![]()
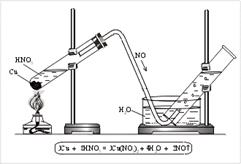
N+2O – оксид азота(II), несолеобразующий оксид. Получают NO реакцией меди с кислотой HNO3 (разб.) (рис. 3).
Кристаллическая решетка молекулярная; молекула легкая, слабополярная (электроотрицательность кислорода немного выше, чем у азота). Можно предположить, что температуры плавления и кипения будут низкими, но выше, чем у азота, т. к. полярность молекулы дает возможность подключать электростатические силы притяжения к просто межмолекулярным силам. Образование димера тоже способствует повышению температуры кипения. Строение молекулы позволяет предположить и невысокую растворимость в воде. Оксид азота(II) не имеет ни цвета, ни запаха.
|
|
|
Рис. 3. Получение оксида азота(II) в лаборатории |
Для получения оксида азота(II) в пробирку помещают немного медных стружек и заливают разбавленную азотную кислоту. Пробирку закрывают пробкой с газоотводной трубкой и укрепляют в штативе. Конец газоотводной трубки опускают в кристаллизатор с водой и далее в цилиндр (рис. 3). При нагревании выделяется NO. NO легко окисляется кислородом воздуха, т. е. действует как восстановитель:
![]()
В реакции с сернистым газом оксид NO – окислитель:
![]()
N+22O3 – оксид азота(III), азотистый ангидрид (ему соответствуют азотистая кислота HNО2 и соли нитриты); это кислотный оксид, для него характерны все свойства кислотных оксидов. Получают оксид N2O3 по реакции:
NO2 + NO ![]() N2O3.
N2O3.
N+4O2– оксид азота(IV), диоксид азота, бурый газ (токсичен).
Рассмотрим электроны азота в молекуле NО. Это неспаренный электрон, свободная пара электронов и еще два электрона на связи с кислородом – всего пять. А у атома кислорода, «выходящего на связь», шесть электронов на четырех орбиталях. Если расположить их по два, то одна орбиталь останется свободной. Именно ее и занимает пара электронов атома азота (рис. 4, 5).
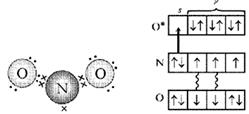
Рис. 4. Схема электронного строения молекулы NO2 (первый вариант). (Точками обозначены электроны атомов О, крестиками – электроны атома N)
Рис. 5. Схема электронного строения молекулы NO2 (второй вариант). (Звездочкой обозначен возбужденный атом O, стрелкой – донорно-акцепторная связь.
Раз пара электронов, находящаяся на s-орбитали, «пошла на связь», она просто обязана подвергнуться гибридизации. Возникает вопрос: какой тип гибридизации использует атом? Ответ: три электронные орбитали азота находятся в состоянии sp2-гибридизации. Молекула NO2 угловая, угол 134° (угол больше 120° потому, что 1 электрон отталкивает от себя электроны связи слабее, чем пара электронов) (рис. 6, 7).
Кристаллическая решетка молекулярная, однако, поскольку сама молекула тяжелее NO и склонность к димеризации у нее заметно выше, то плавиться и кипеть это вещество должно при заметно более высоких температурах. Температура кипения составляет 21 °С, поэтому при обычных условиях – 20 °С и 760 мм рт. ст. – оксид азота(IV) жидкий.
Оксид азота (IV) в воде растворяется, одновременно с ней реагируя, и получается при этом сразу две кислоты.
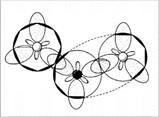
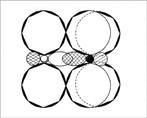
Рис. 6. Молекула NO2 — вид «сверху»
Рис. 7. Молекула NO2 – вид «сбоку», со стороны донорно-акцепторной связи. (Второй атом кислорода не виден за орбиталями атома азота. Заштрихованные кружки – это гибридизованные орбитали атомов, направленные к читателю.)
Актуально о образовании:
Составление спецификации понятий
Таблица 1 – Спецификация понятий Опорное понятие Новое понятие № Названия учебных элементов Символ Уровень усвоения Порядок + 1 Асинхронная машина 1 1 + 2 Асинхронный двигатель АД 1 2 + 3 АД с КЗ ротором АДКЗ 1 3 + 4 АД с фазным ротором АДФР 1 3 + 5 Статор 1 4 + 6 Ротор 1 4 + 7 Магнитопровод 2 5 + ...
Анализ условий организации проблемного обучения в начальной школе
На уроках по двум основным учебным дисциплинам — язык и математика — дети почти все время решают учебно-тренировочные, типовые задачи. Их назначение состоит в том, чтобы поисковая деятельность детей с каждой последующей задачей одного и того же типа постепенно свертывалась и, в конечном счете, совс ...
Управления самостоятельной деятельностью студентов
Анализ современных исследований по проблеме самостоятельной работы студентов показывает, что осуществлять личностный подход, организовывая самостоятельную деятельность студентов, очень сложно. Существующие способы организации самостоятельной работы, традиционные и нетрадиционные, несмотря на внешне ...