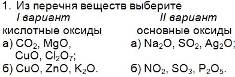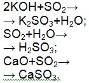План-конспект урока химии с применением технологии модульного обучения
Тема: Кислоты
Цель:
Обобщение понятия о кислотах, изученных в предыдущих темах.
Познакомиться с классификацией кислот и их взаимодействием с солями.
Развивать умение составлять уравнения химических реакций, производить расчеты по ним, осуществлять химический эксперимент.
Методы: объяснение, беседа, упражнения, химический эксперимент.
Форма урока: коллективное изучение нового материала.
Оборудование и реактивы: химическая посуда, CuO, SiO2, Cu, Zn, NaOH, BaCl2, лакмус, метилоранж, фенолфталеин, H2SO4, NaCl.
Основные понятия: кислотные и основные оксиды, кислота, индикатор.
Ход урока:
Вводная часть.
На прошлом уроке мы изучили один из классов неорганических соединений – оксиды, а сегодня обобщим другой класс соединений – кислоты.
|
№ |
Учебный материал с указанием заданий |
Руководство к усвоению |
|
1 |
2 |
3 |
|
Цель: знать химические свойства оксидов (взаимодействие с водой, основаниями, между собой | ||
|
УЭ0 |
Входной контроль (индивидуальное тестирование)
Какая масса соли должна получиться при взаимодействии: І вариант: оксида магния массой 4 г с азотной кислотой? (14,8 г) ІІ вариант: углерод (ІV)-оксида с кальций оксидом массой 15 г? (26,8 г) |
10 минут 2 балла 2 балла 4 балла
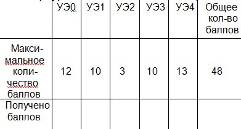
4 балла Максимальное количество баллов – 12 Взаимоконтроль |
|
УЭ1 |
Сравнительная характеристика и номенклатура кислот Цель: исследовать состав и номенклатуру кислот; сравнить формулы кислот. Прочитайте текст учебника на с. 112-113 (до понятия об индикаторах) и ответьте на вопросы: 1.Что общего в формулах кислот? 2.Чем отличается соляная кислота от азотной? 3.Сделайте вывод: как образуются названия бескислородных и кислородсодержащих кислот? |
3 минуты самостоятельная работа в тетрадях. 2 балла 3 балла 5 баллов Максимальное количество баллов - 10 |
|
УЭ2 |
Цель: изучить взаимодействие индикаторов с кислотами. Прочитайте текст учебника на с. 113-115, проследите изменение окраски индикаторов в растворах кислот (таб. 8, с. 115) Демонстрация: взаимодействие азотной кислоты с индикаторами |
5 минуты самостоятельная работа в тетрадях 3 балла |
|
УЭ3 |
Цель: изучить механизм взаимодействия металлов с кислотами; изучить механизм реакции замещения, вытеснительный ряд металлов Демонстрация: Лабораторная работа № 5 Взаимодействие металлов с кислотами Схема опыта: H2SO4 + Mg = H2SO4 + Fe = H2SO4 + Cu = Напишите уравнения возможных реакций. Задание: №8, с. 118 |
10 минут самостоятельная работа 5 баллов 5 баллов |
|
УЭ4 |
Закрепление, систематизация и обобщение изученного материала Работа в малых группах. Цель: относительно быстрый замер уровня усвоения информации путем включения самих учащихся в процесс. В тетрадях учащиеся чертят таблицу:
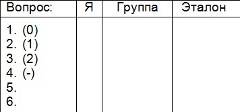
Учащиеся записывают ответы на вопросы в колонку «Я», рядом в скобках проставляют степень уверенности: 0 – не уверен; 1 – сомневаюсь; 2 – уверен; – - нет ответа. После записи ответа в колонку «Я» идет об суждение в малых группах. Если ответы не совпадают, то в колонку «Группа» записывают новый ответ. Затем идет коллективная проверка ответов, и при необходимости в колонку «Эталон» записывается правильный ответ. Вопросы: Укажите валентность кислотного остатка в кремневой кислоте H2SiO3: а) 1;б) 2;в) 3;г) 4. 2. Как можно отличить раствор кислоты от оксида? а) при помощи химических реакций; б) при помощи индикатора; в) попробовать на вкус; г) смешать с водой. 3. Выберите из перечисленных реакций реакцию замещения: а) FeCl2 + H2SO4 → FeSO4 + 2HCl; б) FeSO4 + Cu → CuSO4 + Fe; в) MgO + CO2 → MgCO3; г)Fe + 2HCl → FeCl2 + H2 ↑ 4. Какой из перечисленных металлов не вытесняет водород из кислот? а) Zn; б) Na; в) Cu; г) Fe. 5. Выберите, в каком ряду находятся бескислородные кислоты: а) HCl; H2SO4; HNO3; H2CO3; б) HCl; H2S; HBr; HNO3; в) HCl; HI; H2S; HBr; г) HNO3; H2SO4; H3PO4; H2CO3. 6. Какое химическое количество серной кислоты содержится в порции ее массой 98 г? (Ответ: 1 моль) а) 2 моль; б) 2,5 г; в) 1 моль; г) 3 моль После выполнения работы проводится проверка и выставление баллов. Задание на дом: §24, №1 – 3, с.118, вопросы 4,8 В конце урока заполняется таблица:
|
15 минут Группы по 2 чел. 2 балла 2 балла 2 балла 2 балла 2 балла 2 балла Максимальное количество баллов - 13 |
|
Итоги урока. |
40 – 35 – 10 баллов 34 – 30 – 9 баллов 29 – 25 – 8 баллов 24 – 20 – 7 баллов 19 – 15 – 6 баллов 14 – 10 – 5 баллов 9 – 5 – 4 балла 5 – 3 – 3 балла |
Актуально о образовании:
Культурная революция в народном образовании
После революции, в 1918 году Кукарке был присвоен статус города (48), город стал называться по решению народного собрания Советском (Приложение 2). За годы советской власти на вятской земле совершена подлинная культурная революция и, прежде всего в области народного образования. В Советском уезде в ...
Общая характеристика целей воспитания
Цель — осознанный образ предвосхищаемого результата, на достижение которого направлены действия человека или группы людей; предполагаемый идеальный результат деятельности. Цель воспитания как социального явления — теоретическое обобщение и выражение потребностей общества в определенном типе личност ...
Пальчиковая гимнастика как средство развития мелкой моторики у детей с
нарушением интеллекта на занятиях лечебной физической культуры
Учёные доказали, что с анатомической точки зрения, около трети всей площади двигательной проекции коры головного мозга занимает проекция кисти руки, расположенная очень близко от речевой зоны. Поэтому развитие речи ребёнка неразрывно связано с развитием мелкой моторики. В быту человеку ежеминутно т ...